糖尿病或将告别每日注射基因编辑治疗糖尿病新突破
糖尿病治疗迎来新突破!
最新研究显示,科学家首次将CRISPR编辑的胰岛细胞移植到一名1型糖尿病患者体内。
这些细胞不仅在数月内持续分泌胰岛素,还能逃避免疫检测,使植入接受者无需服用免疫抑制剂。【图1】
此研究已发表在《新英格兰医学杂志》上,并作为新闻登上了Nature官网。
那么,这项突破究竟是如何实现的呢?
1型糖尿病是一种自身免疫性疾病,患者的免疫系统会错误地攻击胰腺中分泌胰岛素的细胞。
一旦胰岛素"停产",身体里的血糖就会失控。
如果不通过注射等方式补充胰岛素,此疾病可能会损害神经和器官,特别是心脏、肾脏和眼睛。【图2】
针对这一问题,华盛顿西雅图Sana Biotechnology公司提出了一项新研究,为全球约950万1型糖尿病病人带来了治愈的希望。
首先,在乌普萨拉大学医院,研究人员从一名没有糖尿病的60岁遗体捐赠者体内提取出胰岛细胞。
随后,这些细胞被运送至奥斯陆大学医院,利用CRISPR-Cas12b基因编辑技术进行改造。
主要做法为敲除了两个关键基因——B2M(I类HLA)和CIITA(II类HLA),这两个基因通常会向T细胞(免疫系统的前线防御者)标记外来入侵者。
为了应对自然杀伤细胞等免疫监视者的攻击,研究人员采取了进一步措施。
他们通过病毒载体,向这些细胞导入了编码CD47蛋白的基因。这种蛋白能够发出"别吃我"的信号,以此迷惑免疫系统。
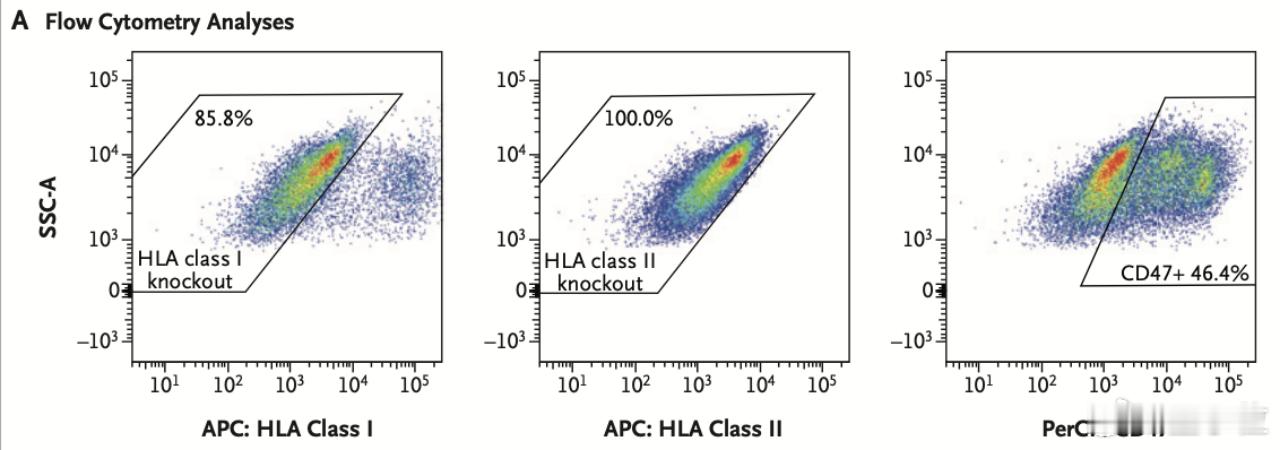
编辑后的胰岛细胞中,85.8%的细胞不再有I类HLA分子,所有细胞都没有II类HLA分子,同时46.4%的细胞在表面高水平表达CD47蛋白。【图3】
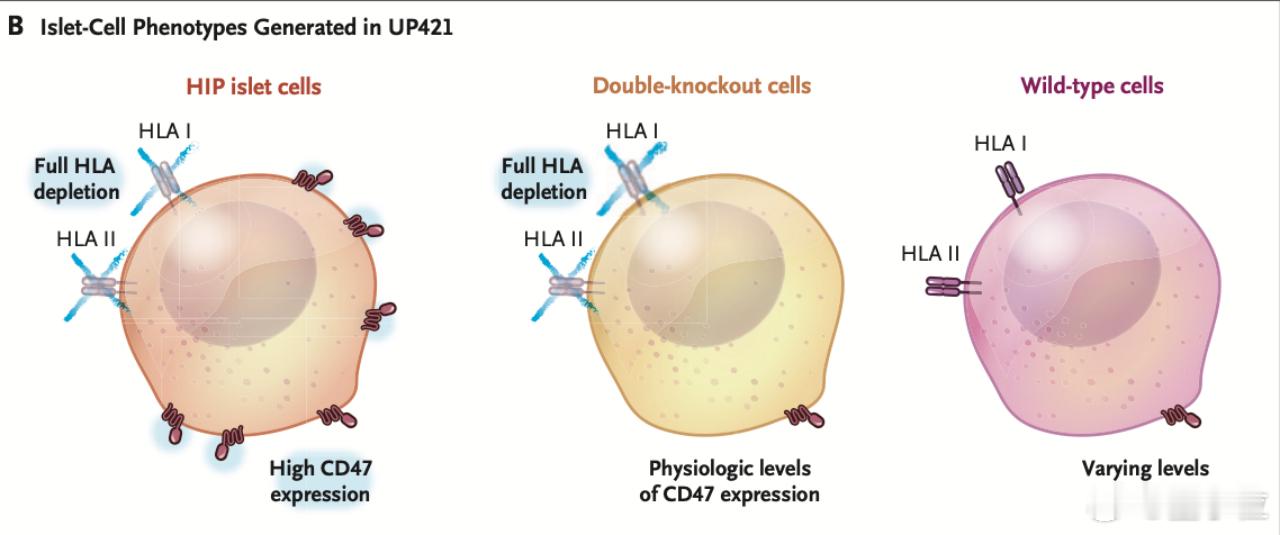
最终基因编辑胰岛细胞制剂UP421由三类细胞组成:
- 完全编辑、HLA缺失且CD47高表达的HIP胰岛细胞;
- 部分I类和II类HLA双敲除、CD47维持内源水平的细胞;
- 保留HLA表达(野生型)且CD47水平各异的胰岛细胞。【图4】
这些编辑后的胰岛细胞被运送回乌普萨拉大学医院进行植入。
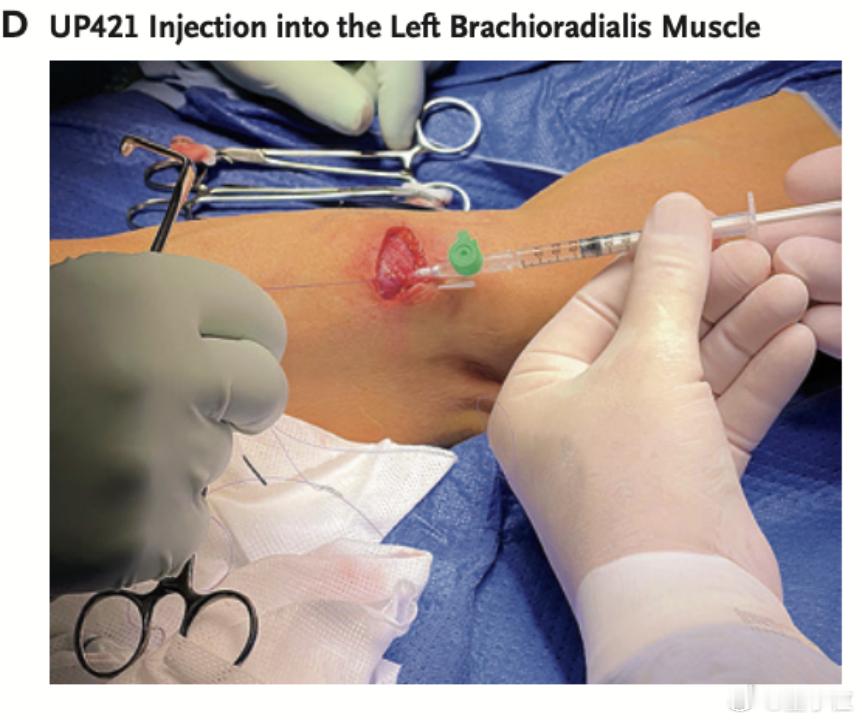
一名42岁、患有37年1型糖尿病的患者在全身麻醉后,于左侧肱桡肌上方开了一处长约3.8厘米的手术切口。
研究人员将总计7960万颗经过工程化改造的HIP胰岛细胞分装于17支注射器中,通过17次注射将其植入肌肉组织。【图5】
每次注射时,医生都采用缓慢回撤的方式,使胰岛细胞以"珍珠串状"线性排列于肌肉中。
术后,患者在院内留观一夜,以监测即时并发症情况,并于次日顺利出院。
值得关注的是,整个治疗过程未使用任何糖皮质激素、抗炎药或免疫抑制药物。
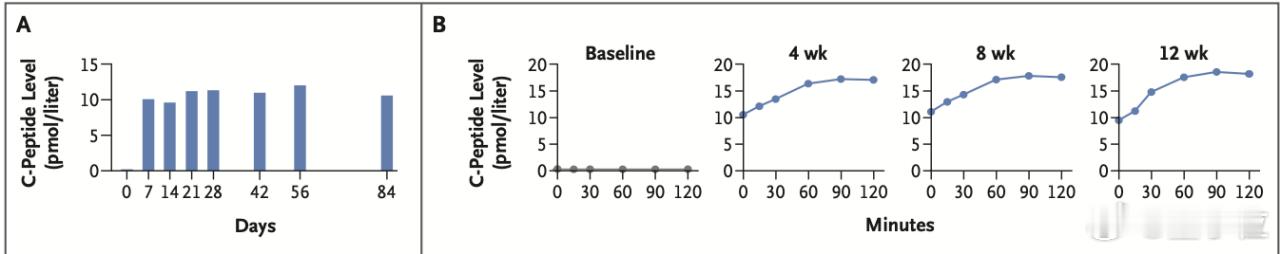
研究显示,移植12周后,这些经过基因编辑的胰岛细胞不仅未出现排斥反应迹象,还能够持续分泌胰岛素,有效调节患者血糖水平。【图6】
作为内源性胰岛素分泌的直接标志物,C肽水平在基线期未能检测出,但在干预后的第4、8及12周均可检测到显著升高。
而且根据Sana Biotechnology公司后续发布的报告,即使在移植6个月后,这些细胞仍能够有效逃避免疫系统的识别与攻击。
需要注意的是,该研究仅涉及一名参与者,他接受的是低剂量细胞治疗,且治疗时间较短,不足以让患者不再需要通过注射胰岛素来控制血糖。
基于此,Sana计划从明年开始进行更多临床试验。以进行更全面的研究。